L’acidité d’un sol concerne sa solution et son complexe argilo-humique. On détermine l’acidité en mesurant le pH (potentiel hydrogène) à l’aide d’un pHmètre. Le pH d’une solution est la quantité d’ions H+ (hydrogène) libres qu’elle contient.
Comment neutraliser l’acidité ?
En apportant régulierement de l’amendement minéral basique, on neutralise les ions H+ (hydrogène) qui sont vecteurs de l’acidité.
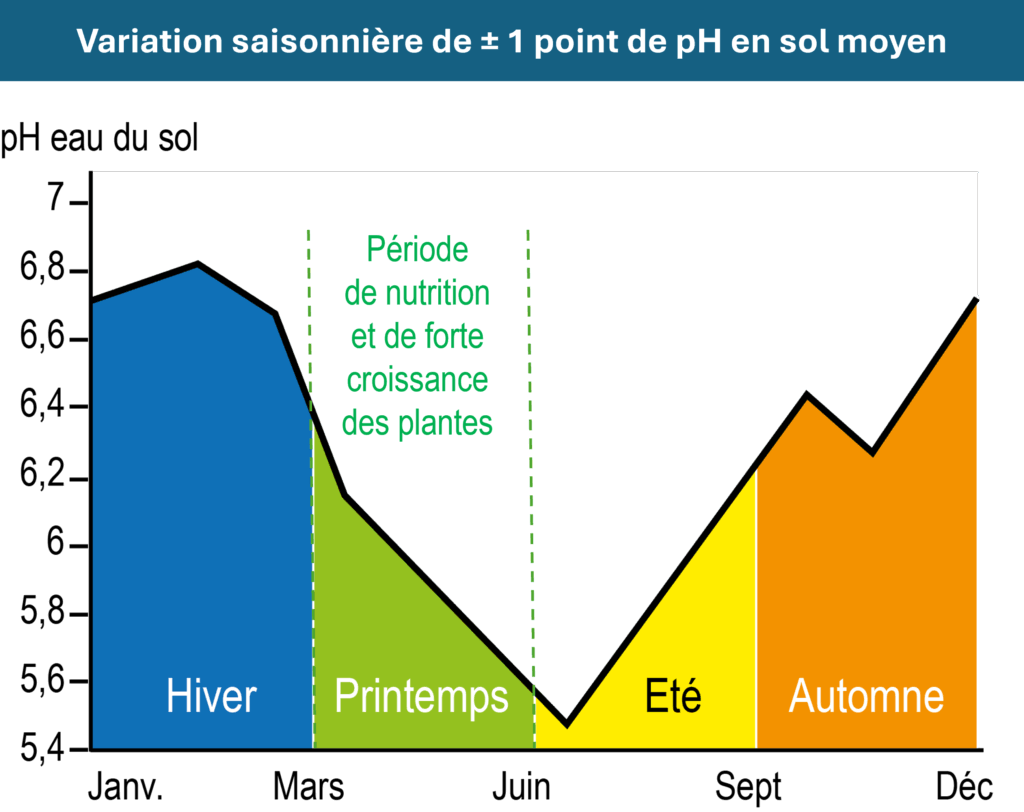
A quelle période de l’année le pH est-il le plus élevé ?
- Le pH évolue au rythme des saisons :
- En hiver la vie du sol et des plantes est au ralenti, le pH monte, l’acidité diminue
- Au printemps tout s’accélère avec l’apport des engrais azotés, le prélèvement des plantes et la forte activité biologique, les mécanismes d’acidification s’accélèrent d’où production d’H+ et donc baisse du pH.
- En été, en cas de sécheresse estivale, le pH remonte avant de redescendre avec le retour des pluies.
Quels sont les besoins de neutralisation ?
- L’acidité est un phénomène naturel qui dépend du contexte pédo climatique, elle est influencée par la nature de la roche et le climat :
- Dans les sols sur roches mères acides (granite, schiste) le besoin de neutralisation est important
- Quand la pluviométrie est importante, le besoin de neutralisation augmente
- Plus le sol est sableux, plus le besoin de neutralisation sera nécessaire.
- En sol moyen, il faut 300 unités de VN par hectare et par an pour entretenir un pH optimum.


